खुशखबर ! जगातील या देशात आजपासून कोरोना लसीकरण सुरू; भारतातही सुरू होऊ शकतं
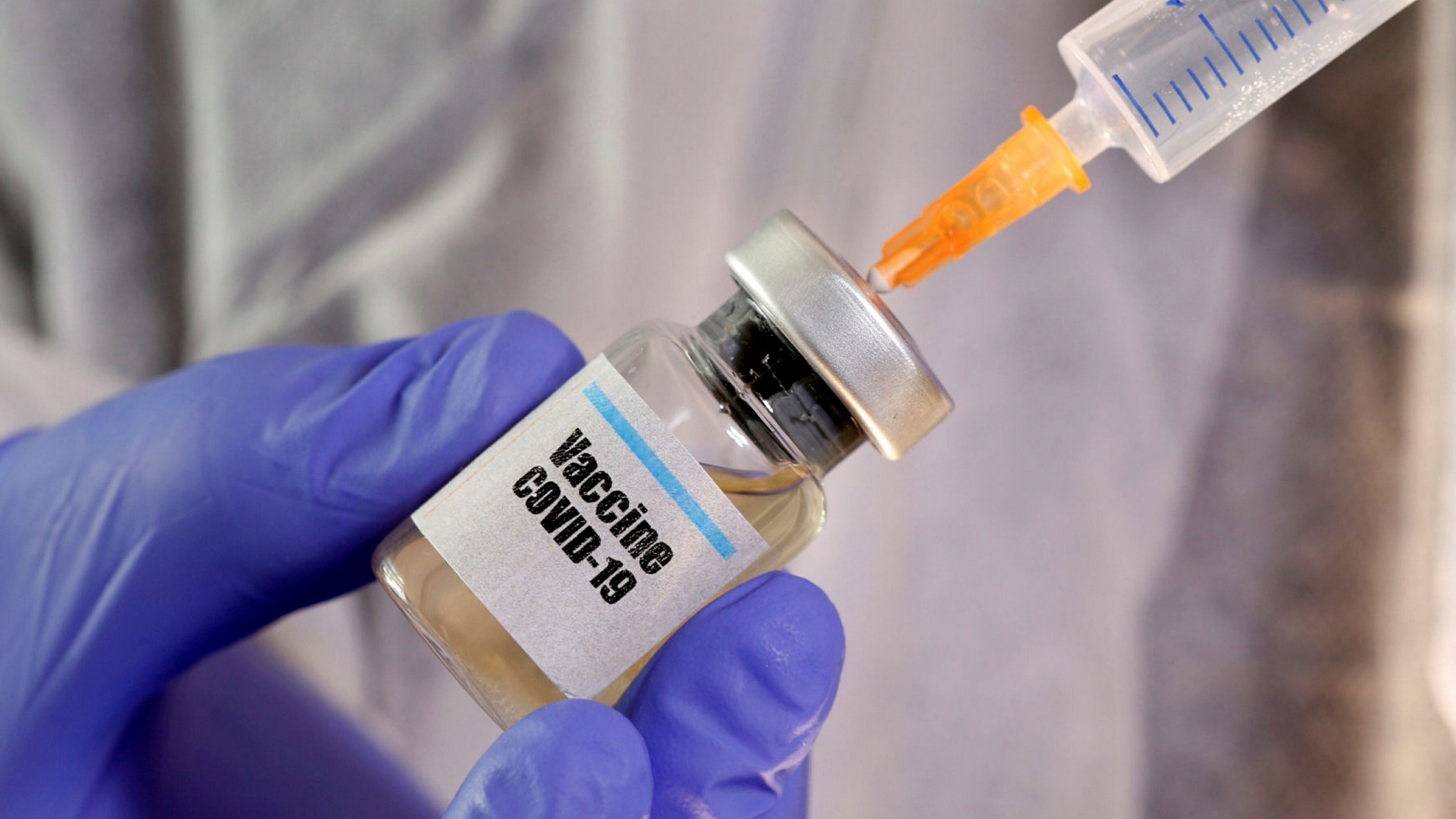
मुंबई – कोरोना व्हायरसच्या माहामारीविरूद्ध लढ्यासाठी जगभर प्रयत्न सुरू आहे. भारतातही लसींच्या शेवटच्या टप्प्प्यातील चाचणी सुरू आहे. यातच आनंदाची बातमी येत आहे. ब्रिटनमध्ये सर्व सामान्य नागरिकांच्या लसीकरणाला सुरूवात झाली आहे. फायजर आणि बायोएनटेक कंपनीकडून विकसित करण्यात आलेल्या कोरोना लसीचे लसीकरण आजपासून सूरू झाले आहे.
ब्रिटनने एका आठवड्यात लसीच्या वापरासाठी मंजूरी दिली. राष्ट्रीय स्वास्थ्य सेवा (एनएचएस) च्या माध्यमातून लोकांपर्यंत ही लस पोहोचवण्याची तयार सुरू आहे. सगळ्यात आधी लस ही आरोग्य सेवेतील कर्मचारी वर्गाला दिली जाणार आहे. त्यानंतर वृद्धांना लस दिली जाईल.
प्रत्येक व्यक्तीला दोन डोजची आवश्यकता असणार आहे.. याप्रमाणे ब्रिटेन ने फाइजर / बायोएनटेकला २० मिलियन लोकांना ४० मिलियन डोस देण्याचे आदेश दिले आहेत. जवळपास ८००,००० डोस पहिल्या आठवड्यात उपलब्ध होण्याची आशा व्यक्त केली जात आहे.
अवश्य वाचाः ब्रिटनमध्ये ९० वर्षीय आजींना कोरोना लसीचा पहिला डोस
ब्रिटनमध्ये 61,434 पेक्षा जास्त मृत्यू हे कोरोना व्हायरसच्या संक्रमणामुळे झाले आहेत. प्रधानमंत्री बोरिस जॉनसन यांनी संयुक्त राज्य अमेरिका या युरोपीय संघाकडून फायजर / बायोएनटेकच्या लसीला रोल-आऊट करून या जीवघेण्या आजाराविरूद्ध एक मोहिम सुरू करण्याची माहिती दिली होती.
दरम्यान सीरम इन्स्टिट्यूट ऑफ इंडियाने कोरोना लस “कोविशील्ड” (Covishield) च्या आपत्कालीन वापराला अधिकृत मान्यता देण्यासाठी ड्रग्स कंट्रोलर जनरल ऑफ इंडियाकडे (डीजीसीआय) परवानगी मागितली आहे. सीरम संस्थेला परवानगी मिळाली तर भारतातील ही पहिली स्वदेशी लस ठरू शकेल.
अवश्य वाचाः कोरोनावरील लस म्हणजे जादूची गोळी नाही! WHOचा इशारा
सीरम इन्स्टिटय़ूट ऑफ इंडियाने तयार केलेल्या ऑक्सफर्डच्या कोविशिल्ड लसीच्या तिसऱ्या टप्प्यातील चाचण्यांना परवानगी मिळाली आहे. अॅस्ट्राजेनेकाची लस सर्वात प्रथम भारतात उपलब्ध करून देण्याचे लक्ष्य असल्याचे सीरम इन्स्टिट्युट ऑफ इंडियाचे प्रमुख अदर पूनावाला यांनी सांगितले होते. त्यानंतर जगातील इतर देशांना पुरवठा करण्याचा विचार आहे. सीरम इन्स्टिट्युटकडून अॅस्ट्राजेनेकाच्या कोरोनावरील लसीचे उत्पादन भारतात सुरू आहे







